2 中国科学院大气物理研究所国际气候与环境科学中心, 北京 100029
2 International Center for Climate and Environment Sciences, Institute of Atmospheric Physics, Chinese Academy of Sciences, Beijing 100029
对流层臭氧(O3)是对生物有害的大气污染物,是光化学烟雾的主要成分。光化学过程是其最主要来源:当混合着各种氮氧化物(NOx)、一氧化碳(CO)和挥发性有机化合物(Volatile Organic Compounds, VOC)的空气在受到日光照射时,便会产生O3(Avnery et al., 2011)。此外,平流层O3也可输送到对流层,导致局部地区O3浓度升高。大量站点的长期观测数据表明:近几十年来,随着人类排放的O3前体物浓度升高(主要来自交通运输、石油化学综合工业、化石燃料和含氮化肥使用)和增温,北半球对流层O3浓度显著上升,上升趋势在亚洲和北美尤为明显(The Royal Society, 2008; IPCC, 2013)。目前全球对流层O3浓度已达30~50 ppb(1 ppb=10-9)(Mills et al., 2016);且预计未来几十年内在重度污染的北半球中纬度地区,仍以每年1~10 ppb的速度持续增加(Fang et al., 2013)。
对流层O3对全球气候和生态系统有重要影响。对流层O3是仅次于CO2和CH4的全球第三大温室气体,其辐射强迫为0.4±0.2 W/m2(IPCC, 2013)。同时,作为一种反应性极高的气体和强氧化剂,O3可对呼吸道、肺、眼睛产生刺激(唐孝炎等,2006),增加哮喘发病率(D’Amato, 2011)。此外,对流层O3被认为是对植被产生最大损害的大气污染物:通过影响陆地植被,进而影响生态系统的生物地球化学循环等(Wittig et al., 2009; Ainsworth et al., 2012)。臭氧污染被认为是农业减产、森林衰退和枯死的主要原因之一(Ashmore, 2005)。
目前关于对流层O3对植被影响的文献已有上百篇,其中绝大部分是关于站点实验观测的。此外,已提出多个对流层O3暴露指数(ozone exposure index)。基于站点观测数据和不同的指数,目前已建立多个对流层O3影响植被的参数化方案,实现站点观测到区域或全球的模拟应用。这些参数化方案被陆面/生态模式及地球系统模式使用,用以提高其陆面生态系统模拟(尤其在碳循环方面的模拟),以及开展该影响在地球系统中所起作用的定量化研究。在梳理既有研究成果的基础上,本文总结了O3对植被影响的观测、参数化方案及其模拟应用方面的研究进展,并提出若干建议,为系统和全面认识对流层O3对植被的影响提供借鉴和参考。
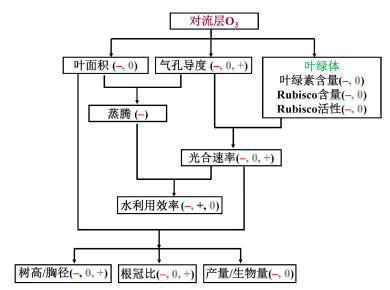
2 观测事实通过分析目前已有的观测研究,O3影响植物生理生化的机制可归纳如下(图 1):在绝大多数情况下,对流层O3可减少叶绿体中的叶绿素含量、Rubisco含量和活性以及增加叶绿体畸形率,并减少叶面积和气孔导度,从而导致植物蒸腾和净光合速率、植被水利用速率、树高/胸径、根冠比以及产量和生物量降低。下面对各个部分进行分述。
|
图 1 对流层O3对植物生理生化指标影响相关机制。符号−、+、0表示(目前已有的上百篇相关观测研究所显示的)O3浓度升高对该植被生理生化指标的影响为减少、增加、或可略。红色符号为O3对植物生理生化指标的主导影响方向 Fig. 1 Mechanisms related to tropospheric O3 impacts on vegetation. The symbols −, +, and 0 denote that O3 tends to reduce, increase, or has limited impacts on the physiological and biochemical characteristics of plants shown in earlier studies. The dominant sign of O3 influence is highlighted in red |
叶绿体是绿色植物光合作用的主要细胞器。O3对叶绿体的影响主要体现在3个方面:1)在高浓度O3暴露下,叶绿体畸形率升高(Pääkkönen et al., 1998);2)O3暴露还会影响叶绿素含量,Booker et al.(2007)指出在植物繁殖阶段,O3浓度的增加会使得叶片叶绿素含量减小17%~28%;3)O3还可降低叶绿体中的Rubisco含量及其活性(Akhtar et al., 2010; Inada et al., 2012)。
在受到O3胁迫时,植物的气孔导度降低是植物避害的一种途径。O3经过叶片气孔进入植物体内,可经过一系列化学反应形成活性氧自由基(Reactive Oxygen Species, ROS),打破细胞内自由基的产生和清除的动态平衡,激发植物体内的保护机制,从而使气孔趋于闭合以减少进入植物体内的O3量。一般而言,速生树种和气孔导度较高的种群对臭氧更敏感(Manninen et al., 2003)。冯兆忠等(2008)对39组小麦的实验数据进行元分析(meta-analysis),结果显示O3会引起气孔导度降低约31%。Wittig et al. (2009)通过元分析指出O3通常使树木气孔导度变小。然而,并不是所有植物的叶片气孔导度在O3影响下均减少。已有研究表明O3浓度升高对挪威松(Kronfuß et al., 1998; Leverenz et al., 1999)、黑樱桃树(Kouterick et al., 2000)、冬小麦(Inada et al., 2012)的气孔导度不产生影响。Maier-Maercker (1989)、Hassan et al. (1994)、Gregg et al. (2006)甚至发现云杉、小萝卜(radish)、棉白杨的气孔导度随O3浓度升高而增加,其原因主要是因为形成层和薄壁组织木化或表皮组织衰弱导致它们对气孔失去了控制。
O3对叶绿体、气孔导度的影响共同决定其对(净)光合速率的影响大小和方向。大多数情况下,O3可通过增加叶绿体畸形率、降低叶绿素和Rubisco含量、以及减少气孔导度来降低光合速率(Mills et al., 2016)。值得注意的是,光合作用对O3的响应程度也可能随叶龄、环境而有所变化。随着叶龄的增长,叶片光合作用通常更容易受到O3影响(Coleman et al., 1995)。而在干旱或高温的环境下,部分植物的光合作用强度在O3浓度较高的情况下反而较无O3试验时高(Karlsson et al., 1997)。
O3能使植物叶片出现不同程度可见伤害症状,从而导致叶面积的降低(Wittig et al., 2009)。叶面积与通过光合作用进入到生态系统的碳量(即初级生产力,Gross Primary Productivity,GPP)之间是正反馈机制。叶面积减少会减少叶片气孔数量,导致GPP降低,进而引起分配到叶的碳量减少,并进一步减少叶面积。同时,气孔数量的减少还会降低植物蒸腾。
气孔导度和叶面积的减少会导致蒸腾的减少。光合速率和气孔导度对O3的敏感性通常不同。Wittig et al. (2007)采用元分析方法量化了已有研究中O3对树木光合速率(348个观测值)和气孔导度(266个观测值)的影响。研究结果表明:工业革命后O3浓度升高使树木净光合速率降低11%± 2%,气孔导度降低13%±2%。Lombardozzi et al. (2013)基于不同植物种类(树、草、农作物)的观测和元分析方法的研究表明:长期的O3暴露会使植被光合作用降低21%和气孔导度降低11%。光合速率和气孔导度对O3敏感性的差异会改变水分利用效率(Water Use Efficiency, WUE)。在O3暴露下,WUE多呈现下降趋势(Booker et al., 2007; Holmes, 2014; Lombardozzi et al., 2015),在一定程度上削弱了植被适应和忍耐干旱的能力。
O3还可改变植物根冠比和植物结构。在O3暴露的情况下,进入生态系统的碳量一般更倾向分配给植株的地上部分而非根部,导致根冠比的减小,引起植物水分或营养供应不足(Kouterick et al., 2000; Zouzoulas et al., 2009)。但也有例外。例如当水资源较为贫乏或养分竞争较为激烈时,在O3暴露下,植物会分配更多生物量用于根系生长,此时根冠比将相应增加,提升其水竞争力(Tjoelker and Luxmoore, 1991),也就是说O3会影响植物对干旱的响应。此外,由于O3导致进入生态系统的碳量减少,常导致树木高度和胸径的减少(Wittig et al., 2009)。
同时,O3还可在一定程度上减小植物的生物量和产量(Li et al., 2016)。McGrath et al.(2015)指出在1980~2011期间,美国旱地小麦和大豆产量受O3影响约减少10%和5%,每年造成90亿美元的经济损失。Wittig et al. (2009)研究表明:相对于外界大气(控制实验),当O3浓度增加到64 ppb时,树木生物量减少11%,当升到97 ppb时,树木生物量减少17%。冯兆忠等(2008)基于39篇观测研究论文的元分析结果表明:O3浓度增加可导致小麦产量降低26%。
此外,大量观测发现,在短期O3暴露后解除其影响,植物将继续生长,而长期高浓度的O3暴露能引起植物代谢紊乱,对其生长产生巨大威胁,甚至导致植物死亡(Grams et al., 1999; Oguntimehin et al., 2010; Chutteang et al., 2016; Cassimiro et al., 2016)。
3 O3暴露指数过去几十年里,多个指数被用于取代瞬时O3浓度,量化站点观测资料所反映的对流层O3暴露与植被响应间的映射关系(exposure-response relationship),并在此基础上建立O3影响植被的参数化方案。这些指数可归为两大类:基于O3浓度的指数和基于O3通量的指数。
基于O3浓度的指数主要包括:AOT40、AOT60、SUM06、W126、M7和M12 (Tai et al., 2014)。其中,AOT40和AOT60分别是指植物生长季节内,气孔打开期间(假设为08:00至20:00),植被冠层处O3浓度超过40 ppb和60 ppb时,超出部分的累积值(Accumulated exposure Over a Threshold Y,AOTY,记为AOTY);其中临界值40 ppb常用于欧洲,60 ppb常用于北美。SUM06是指植物生长季节内,气孔打开期间(假设08:00至20:00),植被冠层处O3浓度超过0.06 ppm(即60 ppb)时,O3浓度的和(SUM,记为SUM)。W126是某一段时间内,臭氧浓度加权(Weighted,W)累计值,加权值与瞬时O3浓度成正比,126为计算公式中所用的系数;M12和M7则是12 h(08:00至20:00)和7 h(09:00至16:00)O3浓度的平均值(Mean,M)。此类指标易于计算,所基于的O3浓度数据也易于测量,但未考虑环境因子和植被状态的变化对植被吸收臭氧通量的影响,且累计时段(08:00至20:00、09:00至16:00)、浓度阈值或W126中权重选取具有较大不确定性(Harmens et al., 2015; Anav et al., 2016)。
近年来,越来越多的研究发现O3对植被的影响与植被的O3吸入量直接相关,只有通过气孔进入到植物体内的那部分O3才能引起植被的一系列生理生化指标的变化,并据此提出基于O3通量的指数(Danielsson et al., 2003; Pleijel et al., 2004, 2007; Hoshika et al., 2011)。其中使用较为广泛的包括CUOY(Cumulative Uptake of Ozone above a threshold of Y,单位:nmol m-2 s-1,CUOY,记为CUOY)和PODY(Phytotoxic Ozone Dose over a threshold of Y,单位:nmol m-2 s-1,PODY,记为PODY)(Dumont et al., 2013; Anav et al., 2016)。CUOY(或PODY)表征植物在一段时间内通过叶片气孔(或阳面叶面气孔)进入到植物体内O3通量超过阈值Y的累积量。PODY最近才开始推荐给观测研究使用。该类指标的计算综合考虑了气孔导度、O3浓度、O3暴露时间对植被的O3吸入量的影响,以及环境因子和植被状态的变化对植被吸收臭氧通量的影响,更严谨且更符合实际情况。但其计算需要叶面气孔导度和O3暴露时间,计算相对基于O3浓度的指数要复杂。
4 参数化方案基于上两节介绍的O3对植被影响的站点观测和O3暴露指数,目前已提出4个O3影响植被的参数化方案,以模拟和定量化O3在区域或全球尺度上对植被的影响。这些参数化方案均可表达为:
| $ Y={{Y}_{\text{p}}}(1-F), $ | (1) |
其中,Y(Yp)表示考虑(未考虑)O3影响的生理生化指标,目前已使用生理生化指标包括:净光合速率、气孔导度、农作物产量;F 是O3对该指标的影响率,为O3暴露指数的函数。
方案一:Felzer et al. (2004)基于Reich (1987)、Tjoelker et al. (1995)和Ollinger et al. (1997)的工作建立了第一个O3影响净光合速率的参数化方案。在该方案中,
| $ F=\alpha {{g}_{\text{s}}}\times {{A}_{\text{OT40}}}, $ | (2) |
其中,gs为气孔导度,α反映净光合速率对gs×AOT40变化的敏感度,依赖于植物功能类型。该参数化方案被Ren et al. (2007a)引入生态模式DLEM(Dynamic Land Ecosystem Model)中。
方案二:Karlsson et al. (2004)和Pleijel et al. (2004)分别通过分析欧洲O3对树木生物量和农作物产量影响,得到了CUOY与植被响应间的映射关系。Sitch et al. (2007)将该映射关系用于全球植被动力学模式MOSES-TRIFFID中,建立O3影响植物净光合速率的参数化方案。在该方案中,
| $ F=a{{U}_{\text{O}Y}}, $ | (3) |
其中UOY 为通过叶片气孔进入到植物体内超过阈值Y的O3瞬时通量。参数a为不同植物功能类型(Plant Functional Type,PFT)对O3的敏感程度系数,通过使模拟的CUOY与O3造成的生物量减少率映射关系与Karlsson et al. (2004)和Pleijel et al. (2004)一致来校准。该参数化方案还被引入英国地球系统模式QUEST的陆面模式JULES (Clark et al., 2011)、生态模式YIBs (Yue and Unger, 2015)和陆面模式NoahMP (Aas, 2012)。
方案三:Lombardozzi et al. (2013)通过对2013年以前观测研究方面的文献进行数据筛选和质量控制,得到草、树、农作物数据点分别49、162、134个。在这基础上采用线性回归,分别建立O3影响植被净光合速率和气孔导度的参数化方案,用于地球系统模式CESM的陆面模式CLM中(Lombardozzi et al., 2015)。在该方案中:
| $ F=a{{C}_{\text{UO}Y}}+b, $ | (4) |
其中,参数a反映净光合速率或气孔导度对CUOY 变化的敏感度;参数b 为当CUOY=0时,O3对净光合速率或气孔导度的影响率,两个参数均依赖于植物功能类型。
方案四:Tai et al. (2014)基于已有观测方面的研究,建立了O3影响农作物产量的参数化方案,在该方案中,
| $ F=aI, $ | (5) |
或
| $ F=1-a\exp (b{{I}^{c}}), $ | (6) |
其中,I为基于O3浓度的臭氧暴露指数:AOT40、SUM06、W126、M7 和M12。正常数a、b、c基于已有的观测方面的研究所得。公式(5)和(6)均反映O3的减产效应随I 的增大而增强。
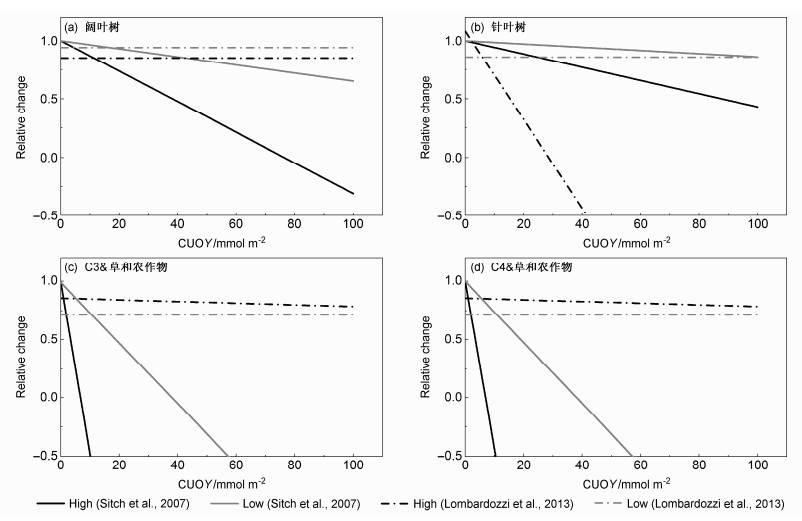
目前认为,基于CUOY与O3植被响应关系的方案二和方案三更适合地球系统模式。但两个方案中关键参数Y、a(b)取值差异很大,最终所模拟的O3对植被的影响也有很大差异。方案二的O3通量阈值Y要远大于方案三人为主观设定的0.8 nmol m-2 s-1,并且考虑了不同植被类型中Y的差异(表 1)。此外,两个方案中a和b值的不同也使方案二估算的O3对净光合速率的抑制强度通常更大,且抑制强度对CUOY变化更敏感(图 2)。
|
|
表 1 方案二和方案三O3影响植被参数化方案中不同PFT的O3通量阈值Y Table 1 O3 flux thresholds Y for plant function type (PFT) s used in the second and third parameterization schemes |
|
图 2 O3影响植被参数化方案二和方案三中不同PFT的CUOY和O3对净光合速率影响率间映射关系(High和Low分别表示植被对O3的高低敏感程度) Fig. 2 Relationships between cumulative uptake of O3 above a threshold (CUOY) and relative changes in net photosynthesis rate in the second and third parameterization schemes (High and Low represent high and low sensitivity of vegetation to O3, respectively) |
在以上4个方案中,方案一和方案二所基于的观测数据具较大的局限性。方案一中仅包含截至到1987年的观测数据,而方案二仅包含欧洲的观测数据。此外,方案三和方案四基于的观测数据点最多,但方案三中的CUOY计算公式错误(Eq.2,Lombardozzi et al., 2013),且阈值Y为主观人为设定,会影响其标定的CUOY与O3影响植被净光合速率和气孔导度的映射关系。方案四所用的臭氧暴露指数没有CUOY好,未考虑环境因子和植被状态的变化对植被吸收臭氧通量的影响。
5 模拟应用O3影响植被的参数化方案已被用于多个模式中,用于定量化该影响在区域和全球上的作用。到目前为止,主要用于估算其对全球和区域碳循环的影响。Sitch et al. (2007)基于方案二和全球植被动力学模式MOSES-TRIFFID的模拟结果表明:因O3将导致2100年全球GPP和生态系统碳储量分别减小14%~23%和9%~17%。Lombardozzi et al. (2015)和Yue and Unger (2015)分别使用方案三的陆面模式CLM4.5SP和方案二的陆面生态模式YIBs,估算出O3使当前全球GPP减少8%~12%和2%~5%。Kvalevå and Myhre (2013)基于方案二与陆面模式CLM4CN,发现氮限制会显著削弱O3对全球陆地碳储量的作用。在区域尺度的应用上,Ren et al.(2007a, 2007b, 2012)基于方案一和陆面生态模式DLEM的模拟结果表明:近几十年,显著上升的AOT40会导致中国草地的净初级生产力(Net Primary Productivity, NPP)、植被碳储量、土壤有机碳储量、生态系统总碳储量分别减小2.5%、10.3%、0.2%、0.3%;中国农田NPP和土壤有机碳储量分别减小10.7%和12.6%;全国NPP和总碳储量分别减小4.5%和0.9%。Aas (2012)基于方案二的陆面模式NoahMP估算出对流层O3导致2009年欧洲北部森林地区的GPP减少了0.58%~1.86%。Yue and Unger (2014)和Yue et al. (2016)基于方案二的陆面生态模式YIBs,估算出1998~2007年间,对流层O3使美国夏季GPP减少2%~5%,对哈佛森林的GPP的变化趋势影响有限。
因为O3抑制了陆地碳汇,会使得更多CO2积累在大气中,改变CO2的辐射强迫(称为O3间接辐射强迫)。Sitch et al. (2007)采用CO2辐射强迫经验公式,预估出2100年O3间接辐射强迫为0.62~1.09 W/m2。Kvalevå and Myhre (2013)采用与Sitch et al. (2007)相同的方案,但使用陆面模式CLM4CN,估算出2004年O3的间接辐射强迫为0.03~0.07 W/m2,氮限制对该估算值的影响不大。
Lombardozzi et al. (2015)基于方案三,估算了2002~2009年O3对植物的毒害作用对全球水、热通量的影响。其研究结果指出O3对植物的毒害作用会减少全球潜热通量,增加感热通量幅度,减少全球植被水分利用效率,增加全球径流量。在干旱地区、亚马逊流域、澳大利亚地区,其对蒸散发(evapotranspiration)和径流影响不明显。由于Lombardozzi et al. (2013)在估算方案三中关键参数时CUOY计算公式错误,Lombardozzi et al. (2015)基于方案三的量化结果会存在偏差,尽管其定性上应该是正确的。
Tai et al. (2014)基于方案一的研究结果表明,O3对未来50年农作物产量的影响依赖于区域和采用的情景(RCPs,Representative Concentration Pathways,RCP4.5和RCP8.5)。Tian et al. (2016)利用包含方案一的DLEM模式,对中国地区1981~2010年气候变化和O3浓度增加对主要农作物产量的影响进行评估。研究发现,在气候变化和对流层O3的作用下,1981~2010年间中国的年农作物产量将减小10.0%±6.2%。
以上模拟均采用大气驱动数据,未与大气模式耦合。目前基于耦合模式的研究只有3个。Pacifico et al. (2015)采用包含方案二的地球系统模式HadGEM2,综合分析了在不同程度生物量燃烧排放量作用下,亚马逊雨林地区NPP的变化情况。研究结果表明生物量燃烧会增加大气中O3浓度,O3浓度增加会使气孔趋于闭合,从而降低NPP以及植物对O3的吸收量,并进一步增大大气中的O3浓度。Super et al. (2015)采用包含方案二的简化生物大气化学模式MXLCH,量化了O3对荷兰Cabauw地区草地生态系统的影响。其研究结果表明O3浓度增加将使气孔导度减少40%、GPP减少15%、潜热通量减少5%。Pacifico et al. (2015)和Super et al. (2015)均得到O3浓度增加会减少气孔导度这一结论。Sadeke et al. (2015)采用包含方案三的地球系统模式CESM1.2,估算了O3浓度—植被耦合的影响。结果表明O3浓度—植被耦合促使气孔闭合,降低植被对O3的吸收,从而造成大气中O3浓度加大和O3对GPP的抑制作用增强,所导致的大气CO2浓度增强会产生增暖效应。
6 问题与建议目前几乎所有O3影响植被的观测研究均是在北半球热带外地区开展的,缺乏对热带地区的观测研究。已有参数化方案中,热带地区植被对O3的响应关系均用北半球热带外地区的响应关系来代替。众所周知,热带地区是碳、水、热通量的高值区,这种替代的准确程度关系到基于模式估算的热带(甚至可能是全球)对流层O3在地球系统中的作用,以及模式对该地区碳、水、热通量的模拟水平。因此,我们建议在热带开展更多的观测,在此基础上检验该替代的准确性或校准O3影响植被参数化方案中热带PFT的关键参数,减少在估算O3通过影响植被进而影响陆面碳、水、热通量和状态量以及气候时的不确定性。
在已有的站点观测中,有近一半的研究未报告相应的气孔导度值或O3暴露时间(Wittig et al., 2007; Lombardozzi et al., 2013)。这导致无法计算出CUOY,从而使基于CUOY的参数化方案(方案二和方案三)在关键参数校准时所能使用的观测资料数量较少(Sun and Mu, 2016)。在今后的观测实验中,应鼓励研究人员测量气孔导度或测量计算气孔导度所需的环境参数,并在相应的文章中给出O3暴露时间和气孔导度值。
已有的O3影响植被观测和模拟应用工作均表明该影响会对陆—气碳、水、热交换,气候与环境、农作物产量有重要影响,是重要的地球系统过程。然而,目前只有QUEST、CESM和HadGEM2三个地球系统模式考虑了这一过程,使用了方案二和方案三,而这两个方案都存在比较大的问题。方案二中净O3—植被响应关系仅基于欧洲的观测资料(Sitch et al., 2007);方案三中,基于观测的气孔导度、O3浓度、O3暴露时间计算CUOY时公式错误(Lombardozzi et al., 2013),Eq.2中应除以气孔对O3和水的阻抗比(1.67)而非乘以该项,而且其使用的CUOY的阈值Y为人为设定。在以后的参数化方案发展中,需要处理和使用更多已有的观测资料用以减少估算参数化方案中关键参数的不确定性,对观测数据的处理和使用也需谨慎。
目前O3影响植被参数化方案的模拟应用主要集中在估算O3对区域和全球碳循环的影响上,很少研究估算其对陆面水、能量收支、陆表温度、农业产量的影响,仍未有研究开展其对植被分布的影响。而且现有模拟研究大多是在离线模式下运行的,忽略了其它环境、气候要素的协同作用以及O3通过影响陆面植被对气候的反馈。此外,所有模式仅考虑了O3减少GPP的单向变化,未考虑由此导致的大气CO2浓度上升对生态系统的施肥效应。如果考虑由此导致的施肥效应,O3对GPP的影响会有所削弱。因此,今后有必要开展该影响对植被分布变化的作用,以及基于地球系统模式估算O3通过影响植被进而对碳、水、能量收支、气候的影响。
从已有的关于O3影响的定量化研究可知:O3对区域和全球碳循环,陆面水、热、能量收支,气候的影响显著(Lombardozzi et al., 2015),与火灾(全球尺度上最重要的陆面生态干扰过程)的影响相当(Li et al., 2014; Li and Lawrence, 2017)。目前,国内自发研制的全球植被模型IAP-DGVM (Zeng et al., 2014)和AVIM (Ji, 1995; Dan and Ji, 2007)还未包含相关参数化方案,我们建议相关模式组发展或引入O3影响生态系统的参数化方案,并采用离线或使用其所在的地球系统模式CAS-ESM和气候系统模式BCC_CSM(Wu et al., 2013)开展O3对中国和全球气候与环境的影响研究。
| [] | Aas K S. 2012. Ozone suppression of carbon uptake by vegetation: A model study of the effect of ozone on carbon uptake and storage in boreal forests in northern Europe [D]. M. S. thesis, Department of Geosciences, Faculty of Mathematics and Nature Sciences, University of Oslo, 86pp. |
| [] | Ainsworth E A, Yendrek C R, Sitch S, et al. 2012. The effects of tropospheric ozone on net primary productivity and implications for climate change[J]. Annual Review of Plant Biology, 63(1): 637–661. DOI:10.1146/annurev-arplant-042110-103829 |
| [] | Akhtar N, Yamaguchi M, Inada H, et al. 2010. Effects of ozone on growth, yield and leaf gas exchange rates of two Bangladeshi cultivars of wheat (Triticum aestivum L.)[J]. Environmental Pollution, 158(5): 1763–1767. DOI:10.1016/j.envpol.2009.11.011 |
| [] | Anav A, De Marco A, Proietti C, et al. 2016. Comparing concentration-based (AOT40) and stomatal uptake (PODY) metrics for ozone risk assessment to European forests[J]. Global Change Biology, 22(4): 1608–1627. DOI:10.1111/gcb.13138 |
| [] | Ashmore M R. 2005. Assessing the future global impacts of ozone on vegetation[J]. Plant, Cell and Environment, 28(8): 949–964. DOI:10.1111/j.1365-3040.2005.01341.x |
| [] | Avnery S, Mauzerall D L, Liu J F, et al. 2011. Global crop yield reductions due to surface ozone exposure: 2.Year 2030 potential crop production losses and economic damage under two scenarios of O3 pollution[J]. Atmos. Environ., 45(13): 2297–2309. DOI:10.1016/j.atmosenv.2011.01.002 |
| [] | Booker F L, Burkey K O, Pursley W A, et al. 2007. Elevated carbon dioxide and ozone effects on peanut: Ⅰ.Gas-exchange, biomass, and leaf chemistry[J]. Crop Science, 47(4): 1475–1487. DOI:10.2135/cropsci2006.08.0537 |
| [] | Cassimiro J C, Moura B B, Alonso R, et al. 2016. Ozone stomatal flux and O3 concentration-based metrics for Astronium graveolens Jacq., a Brazilian native forest tree species[J]. Environmental Pollution, 213: 1007–1015. DOI:10.1016/j.envpol.2016.01.005 |
| [] | Chutteang C, Booker F L, Na-Ngern P, et al. 2016. Biochemical and physiological processes associated with the differential ozone response in ozone-tolerant and sensitive soybean genotypes[J]. Plant Biology, 18(S1): 28–36. DOI:10.1111/plb.12347 |
| [] | Clark D B, Mercado L M, Sitch S, et al. 2011. The Joint UK Land Environment Simulator (JULES), model description—Part 2: Carbon fluxes and vegetation dynamics[J]. Geoscientific Model Development, 4(3): 701–722. DOI:10.5194/gmd-4-701-2011 |
| [] | Coleman M D, Isebrands J G, Dickson R E, et al. 1995. Photosynthetic productivity of aspen clones varying in sensitivity to tropospheric ozone[J]. Tree Physiology, 15(9): 585–592. DOI:10.1093/treephys/15.9.585 |
| [] | D'Amato G. 2011. Effects of climatic changes and urban air pollution on the rising trends of respiratory allergy and asthma[J]. Multidisciplinary Respiratory Medicine, 6(1): 28. DOI:10.1186/2049-6958-6-1-28 |
| [] | Dan L, Ji J J. 2007. The surface energy, water, carbon flux and their intercorrelated seasonality in a global climate-vegetation coupled model[J]. Tellus B, 59(3): 425–438. DOI:10.1111/j.1600-0889.2007.00274.x |
| [] | Danielsson H, Karlsson G P, Karlsson P E, et al. 2003. Ozone uptake modelling and flux-response relationships—An assessment of ozone-induced yield loss in spring wheat[J]. Atmos. Environ., 37(4): 475–485. DOI:10.1016/S1352-2310(02)00924-X |
| [] | Dumont J, Spicher F, Montpied P, et al. 2013. Effects of ozone on stomatal responses to environmental parameters (blue light, red light, CO2 and vapour pressure deficit) in three Populus deltoids × Populus nigra genotypes[J]. Environmental Pollution, 173: 85–96. DOI:10.1016/j.envpol.2012.09.026 |
| [] | Fang Y Y, Mauzerall D L, Liu J F, et al. 2013. Impacts of 21st century climate change on global air pollution-related premature mortality[J]. Climatic Change, 121(2): 239–253. DOI:10.1007/s10584-013-0847-8 |
| [] | Felzer B, Kicklighter D, Melillo J, et al. 2004. Effects of ozone on net primary production and carbon sequestration in the conterminous United States using a biogeochemistry model[J]. Tellus B, 56: 230–248. DOI:10.3402/tellusb.v56i3.16415 |
| [] | 冯兆忠, 小林和彦, 王效科, 等. 2009. 小麦产量形成对大气臭氧浓度升高响应的整合分析[J]. 科学通报, 54(2): 249–255. Feng Zhaozhong, Kobayashi K, Wang Xiaoke, et al. 2009. A meta-analysis of responses of wheat yield formation to elevated ozone concentration[J]. Chinese Science Bulletin, 54(2): 249–255. |
| [] | Grams T E E, Anegg S, Häberle K H, et al. 1999. Interactions of chronic exposure to elevated CO2 and O3 levels in the photosynthetic light and dark reactions of European beech (Fagus sylvatica)[J]. New Phytologist, 144(1): 95–107. DOI:10.1046/j.1469-8137.1999.00486.x |
| [] | Gregg J W, Jones C G, Dawson T E. 2006. Physiological and developmental effects of O3 on cottonwood growth in urban and rural sites[J]. Ecological Applications, 16(6): 2368–2381. DOI:10.1890/1051-0761(2006)016[2368:PADEOO]2.0.CO;2 |
| [] | Harmens H, Mills G, Hayes F, et al. 2015. Twenty eight years of ICP Vegetation: An overview of its activities[J]. Annali di Botanica, 5: 31–43. DOI:10.4462/annbotrm-13064 |
| [] | Hassan I A, Ashmore M R, Bell J N B. 1994. Effects of O3 on the stomatal behaviour of Egyptian varieties of radish (Raphanus sativus L. cv. Baladey) and turnip (Brassica rapa L. cv. Sultani)[J]. New Phytologist, 128(2): 243–249. DOI:10.1111/j.1469-8137.1994.tb04008.x |
| [] | Holmes C D. 2014. Air pollution and forest water use[J]. Nature, 507(7491): E1–E2. DOI:10.1038/nature13113 |
| [] | Hoshika Y, Hajima T, Shimizu Y, et al. 2011. Estimation of stomatal ozone uptake of deciduous trees in East Asia[J]. Annals of Forest Science, 68(3): 607–616. DOI:10.1007/s13595-011-0051-9 |
| [] | Inada H, Kondo T, Akhtar N, et al. 2012. Relationship between cultivar difference in the sensitivity of net photosynthesis to ozone and reactive oxygen species scavenging system in Japanese winter wheat (Triticum aestivum)[J]. Physiologia Plantarum, 146(2): 217–227. DOI:10.1111/j.1399-3054.2012.01618.x |
| [] | IPCC. 2013. Climate Change 2013: The Physical Science Basis [M]. Stocker T F, Qin D, Plattner G K, et al., Eds. Cambridge, United Kingdom and New York, NY, USA: Cambridge University Press. |
| [] | Ji J J. 1995. A climate-vegetation interaction model: Simulating physical and biological processes at the surface[J]. Journal of Biogeography, 22(2-3): 445–451. DOI:10.2307/2845941 |
| [] | Karlsson P E, Medin E L, Wallin G, et al. 1997. Effects of ozone and drought stress on the physiology and growth of two clones of Norway spruce (Picea abies)[J]. New Phytologist, 136(2): 265–275. DOI:10.1046/j.1469-8137.1997.00735.x |
| [] | Karlsson P E, Uddling J, Braun S, et al. 2004. New critical levels for ozone effects on young trees based on AOT40 and simulated cumulative leaf uptake of ozone[J]. Atmos. Environ., 38(15): 2283–2294. DOI:10.1016/j.atmosenv.2004.01.027 |
| [] | Kouterick K B, Skelly J M, Fredericksen T S, et al. 2000. Foliar injury, leaf gas exchange and biomass responses of black cherry (Prunus serotina Ehrh.) half-sibling families to ozone exposure[J]. Environmental Pollution, 107(1): 117–126. DOI:10.1016/S0269-7491(99)00125-6 |
| [] | Kronfuß G, Polle A, Tausz M, et al. 1998. Effects of ozone and mild drought stress on gas exchange, antioxidants and chloroplast pigments in current-year needles of young Norway spruce [Picea abies (L.) Karst.][J]. Trees, 12(8): 482–489. DOI:10.1007/PL00009730 |
| [] | Kvalevåg M M, Myhre G. 2013. The effect of carbon-nitrogen coupling on the reduced land carbon sink caused by tropospheric ozone[J]. Geophys. Res. Lett., 40(12): 3227–3231. DOI:10.1002/grl.50572 |
| [] | Leverenz J W, Paludan-Müller G, Saxe H. 1999. Response to three seasons of elevated ozone in the progeny of healthy and unhealthy Norway spruce trees from a plantation with the 'top dying' syndrome[J]. New Phytologist, 142(2): 259–270. DOI:10.1046/j.1469-8137.1999.00387.x |
| [] | Li F, Bond-Lamberty B, Levis S. 2014. Quantifying the role of fire in the Earth system—Part 2: Impact on the net carbon balance of global terrestrial ecosystems for the 20th century[J]. Biogeosciences, 11(5): 1345–1360. DOI:10.5194/bg-11-1345-2014 |
| [] | Li C H, Meng J, Guo L Y, et al. 2016. Effects of ozone pollution on yield and quality of winter wheat under flixweed competition[J]. Environmental and Experimental Botany, 129: 77–84. DOI:10.1016/j.envexpbot.2015.11.011 |
| [] | Li F, Lawrence D M. 2017. Role of fire in the global land water budget during the twentieth century due to changing ecosystems[J]. J. Climate, 30: 1893–1908. DOI:10.1175/JCLI-D-16-0460.1 |
| [] | Lombardozzi D, Sparks J P, Bonan G. 2013. Integrating O3 influences on terrestrial processes: Photosynthetic and stomatal response data available for regional and global modeling[J]. Biogeosciences, 10(11): 6815–6831. DOI:10.5194/bg-10-6815-2013 |
| [] | Lombardozzi D, Levis S, Bonan G, et al. 2015. The influence of chronic ozone exposure on global carbon and water cycles[J]. J. Climate, 28(1): 292–305. DOI:10.1175/JCLI-D-14-00223.1 |
| [] | Maier-Maercker U. 1989. Delignification of subsidiary and guard cell walls of Picea abies (L.) Karst. by fumigation with ozone[J]. Trees, 3(1): 57–64. DOI:10.1007/BF00202401 |
| [] | Manninen S, Siivonen N, Timonen U, et al. 2003. Differences in ozone response between two Finnish wild strawberry populations[J]. Environmental and Experimental Botany, 49(1): 29–39. DOI:10.1016/S0098-8472(02)00046-1 |
| [] | McGrath J M, Betzelberger A M, Wang S W, et al. 2015. An analysis of ozone damage to historical maize and soybean yields in the United States[J]. Proceedings of the National Academy of Sciences of the United States of America, 112(46): 14390–14395. DOI:10.1073/pnas.1509777112 |
| [] | Mills G, Harmens H, Wagg S, et al. 2016. Ozone impacts on vegetation in a nitrogen enriched and changing climate[J]. Environmental Pollution, 208: 898–908. DOI:10.1016/j.envpol.2015.09.038 |
| [] | Oguntimehin I, Eissa F, Sakugawa H. 2010. Simultaneous ozone fumigation and fluoranthene sprayed as mists negatively affected cherry tomato (Lycopersicon esculentum Mill)[J]. Ecotoxicology and Environmental Safety, 73(5): 1028–1033. DOI:10.1016/j.ecoenv.2010.04.003 |
| [] | Ollinger S V, Aber J D, Reich P B. 1997. Simulating ozone effects on forest productivity: Interactions among leaf-, canopy-, and stand-level processes[J]. Ecological Applications, 7(4): 1237–1251. DOI:10.1890/1051-0761(1997)007[1237:SOEOFP]2.0.CO;2 |
| [] | Pääkkönen E, Vahala J, Pohjola M, et al. 1998. Physiological, stomatal and ultrastructural ozone responses in birch (Betula pendula Roth.) are modified by water stress[J]. Plant, Cell and Environment, 21(7): 671–684. DOI:10.1046/j.1365-3040.1998.00303.x |
| [] | Pacifico F, Folberth G A, Sitch S, et al. 2015. Biomass burning related ozone damage on vegetation over the Amazon forest: A model sensitivity study[J]. Atmospheric Chemistry and Physics, 15(5): 2791–2804. DOI:10.5194/acp-15-2791-2015 |
| [] | Pleijel H, Danielsson H, Ojanperä K, et al. 2004. Relationships between ozone exposure and yield loss in European wheat and potato—A comparison of concentration-and flux-based exposure indices[J]. Atmos. Environ., 38(15): 2259–2269. DOI:10.1016/j.atmosenv.2003.09.076 |
| [] | Pleijel H, Danielsson H, Emberson L, et al. 2007. Ozone risk assessment for agricultural crops in Europe: Further development of stomatal flux and flux-response relationships for European wheat and potato[J]. Atmos. Environ., 41(14): 3022–3040. DOI:10.1016/j.atmosenv.2006.12.002 |
| [] | Reich P B. 1987. Quantifying plant response to ozone: A unifying theory[J]. Tree Physiology, 3(1): 63–91. DOI:10.1093/treephys/3.1.63 |
| [] | Ren W, Tian H Q, Chen G S, et al. 2007a. Influence of ozone pollution and climate variability on net primary productivity and carbon storage in China's grassland ecosystems from 1961 to 2000[J]. Environmental Pollution, 149(3): 327–335. DOI:10.1016/j.envpol.2007.05.029 |
| [] | Ren W, Tian H Q, Liu M L, et al. 2007b. Effects of tropospheric ozone pollution on net primary productivity and carbon storage in terrestrial ecosystems of China[J]. J. Geophys. Res., 112: D22S09. DOI:10.1029/2007JD008521 |
| [] | Ren W, Tian H Q, Tao B, et al. 2012. China's crop productivity and soil carbon storage as influenced by multifactor global change[J]. Global Change Biology, 18(9): 2945–2957. DOI:10.1111/j.1365-2486.2012.02741.x |
| [] | Sadeke M, Tai A P K, Lombardozzi D, et al. 2015. Impacts of ozone-vegetation interactions and biogeochemical feedbacks on atmospheric composition and air quality under climate change [C]//2015 AGU Fall Meeting. San Francisco, 1. |
| [] | Sitch S, Cox P M, Collins W J, et al. 2007. Indirect radiative forcing of climate change through ozone effects on the land-carbon sink[J]. Nature, 448(7155): 791–794. DOI:10.1038/nature06059 |
| [] | Sun G D, Mu M. 2016. A new approach to identify the sensitivity and importance of physical parameters combination within numerical models using the Lund-Potsdam-Jena (LPJ) model as an example[J]. Theor. Appl. Climatol., 128(3-4): 587–601. DOI:10.1007/s00704-015-1690-9 |
| [] | Super I, Vilà-Guerau de Arellano J, Krol M C. 2015. Cumulative ozone effect on canopy stomatal resistance and the impact on boundary layer dynamics and CO2 assimilation at the diurnal scale: A case study for grassland in the Netherlands[J]. J. Geophys. Res., 120(7): 1348–1365. DOI:10.1002/2015JG002996 |
| [] | Tai A P K, Martin M V, Heald C L. 2014. Threat to future global food security from climate change and ozone air pollution[J]. Nature Climate Change, 4(9): 817–821. DOI:10.1038/nclimate2317 |
| [] | 唐孝炎, 张远航, 邵敏, 等. 2006. 大气环境化学(第2版) [M]. 北京: 高等教育出版社: 739. Tang Xiaoyan, Zhang Yuanhang, Shao Min, et al. 2006. Atmosphere Environmental Chemistry(2nd ed) [M]. Beijing: Higher Education Press: 739. |
| [] | The Royal Society. 2008. Ground-Level Ozone in the 21st Century: Future Trends, Impacts and Policy Implications[M]. London: The Royal Society. |
| [] | Tian H Q, Ren W, Tao B, et al. 2016. Climate extremes and ozone pollution: A growing threat to China's food security[J]. Ecosystem Health and Sustainability, 2(1): 1–10. DOI:10.1002/ehs2.1203 |
| [] | Tjoelker M G, Luxmoore R J. 1991. Soil nitrogen and chronic ozone stress influence physiology, growth and nutrient status of Pinus taeda L.and Liriodendron tulipifera L. seedlings[J]. New Phytologist, 119(1): 69–81. DOI:10.1111/j.1469-8137.1991.tb01009.x |
| [] | Tjoelker M G, Volin J C, Oleksyn J, et al. 1995. Interaction of ozone pollution and light effects on photosynthesis in a forest canopy experiment[J]. Plant, Cell and Environment, 18(8): 895–905. DOI:10.1111/j.1365-3040.1995.tb00598.x |
| [] | Wittig V E, Ainsworth E A, Long S P. 2007. To what extent do current and projected increases in surface ozone affect photosynthesis and stomatal conductance of trees? A meta-analytic review of the last 3 decades of experiments[J]. Plant, Cell and Environment, 30(9): 1150–1162. DOI:10.1111/j.1365-3040.2007.01717.x |
| [] | Wittig V E, Ainsworth E A, Naidu S L, et al. 2009. Quantifying the impact of current and future tropospheric ozone on tree biomass, growth, physiology and biochemistry: A quantitative meta-analysis[J]. Global Change Biology, 15(2): 396–424. DOI:10.1111/j.1365-2486.2008.01774.x |
| [] | Wu T W, Li W P, Ji J J, et al. 2013. Global carbon budgets simulated by the Beijing Climate Center Climate System Model for the last century[J]. J. Geophys. Res., 118(10): 4326–4347. DOI:10.1002/jgrd.50320 |
| [] | Yue X, Unger N. 2014. Ozone vegetation damage effects on gross primary productivity in the United States[J]. Atmospheric Chemistry and Physics, 14(17): 9137–9153. DOI:10.5194/acp-14-9137-2014 |
| [] | Yue X, Unger N. 2015. The Yale interactive terrestrial biosphere model version 1.0: Description, evaluation and implementation into NASA GISS ModelE2[J]. Geoscientific Model Development, 8(8): 2399–2417. DOI:10.5194/gmd-8-2399-2015 |
| [] | Yue X, Keenan T F, Munger W, et al. 2016. Limited effect of ozone reductions on the 20-year photosynthesis trend at Harvard forest[J]. Global Change Biology, 22(11): 3750–3759. DOI:10.1111/gcb.13300 |
| [] | Zeng X D, Li F, Song X. 2014. Development of the IAP dynamic global vegetation model[J]. Adv. Atmos. Sci., 31(3): 505–514. DOI:10.1007/s00376-013-3155-3 |
| [] | Zouzoulas D, Koutroubas S D, Vassiliou G, et al. 2009. Effects of ozone fumigation on cotton (Gossypium hirsutum L.) morphology, anatomy, physiology, yield and qualitative characteristics of fibers[J]. Environmental and Experimental Botany, 67(1): 293–303. DOI:10.1016/j.envexpbot.2009.05.016 |
 2017, Vol. 22
2017, Vol. 22


